INTRODUCCIÓN
Una sal es un compuesto químico formado por la unión de átomos de elementos metálicos y no metálicos unidos mediantes enlaces iónicos, que forman cristales generalmente solubles en agua, producto típicamente de una reacción entre un ácido y una base. Cuando en química hablamos de sal, hacemos referencia a un grupo grande e importante de compuestos, que van desde el cloruro de sodio (la sal de mesa), el yeso, pasando por sales de metales pesados, como el Yoduro de plomo, hasta sales de metales nobles, como el vanadato de amonio. Y comprender el comportamiento de este tipo de compuestos es muy importante, ya que, tanto en la industria, el ambiente y la salud, muchos procesos y problemas están relacionados con la solubilidad de las sales.
OBJETIVOS
- Aprender a obtener sales a partir de diferentes sustancias y métodos
- Analizar el porque surgió dicha reacción
- Practicar la estructuración de una sal con ayuda de los conocimientos adquiridos
MARCO TEÓRICO
Una sal es un compuesto químico formado por la unión de átomos de elementos metálicos y no metálicos unidos mediante enlaces iónicos, que forman cristales generalmente solubles en agua, producto típicamente de una reacción entre un ácido y una base.
La presencia de las sales en la naturaleza, y los procesos para su extracción, recuperación y purificación, y uso dependen en gran medida del fenómeno de solubilidad y de su química cuando se encuentran en solución, siendo estos la disolución, cristalización, hidrólisis y formación de complejos. En el presente post describiremos algunos aspectos generales de estos compuestos.
- Formación de las sales
En cuanto a lo que química se refiere, podemos encontrar diferentes tipos de reacciones que conducen a la formación de sales. Siendo estas:
- Neutralización: es la forma más común de obtener sales, se obtienen mediante la reacción entre un ácido y una base, el ejemplo más común de todos es la neutralización del ácido clorhídrico con hidróxido de sodio para formar sal común (NaCl) y agua.
2. Reacción de desplazamiento entre un metal y un ácido: En esta reacción el átomo de un metal desplaza al átomo de hidrogeno del ácido. Por ejemplo, en la siguiente reacción:
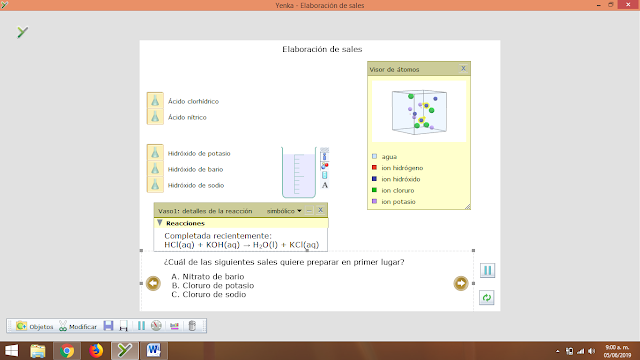
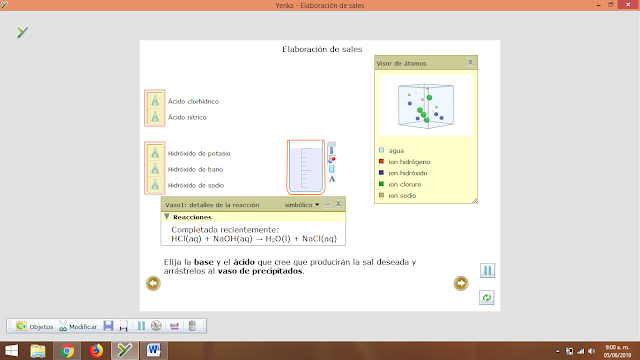
- Elaboración de sales
1. Nitrato de Bario
2. Cloruro de Potasio
3. Cloruro de Sodio
- Reacciones en equilibrio
1. Litio
2. Sodio
3. Potasio
Aquí encontraras información acerca del balanceo de ecuaciones químicas, algunos ejemplos de la realidad, las partes que conforman una ecuación química, así como la ley de conservación de la materia que a continuación se mencionara. Lo que quiere decir es que los átomos en una ecuación química se reorganizan, obteniendo el mismo número de átomos en los reactivos y productos, para llevar a cabo este proceso existen varios métodos: el método redox, método de balanceo algebraico, método de ion- electrón y el método de tanteo.
OBJETIVO
El objetivo de balancear una ecuación química es hacer que cumpla con la Ley de la conservación de la masa la cual establece que en una reacción química la masa de los reactivos debe ser igual a la masa de los productos.
MARCO TEÓRICO
Reacción y Ecuación Química
• Una reacción química es un proceso en el que una sustancia (o sustancias) cambia para formar una o más sustancias nuevas.
• Una ecuación química, es la manera de representar una reacción química, esta utiliza una serie de símbolos químicos para mostrar qué sucede durante dicha reacción.
* Balanceo por tanteo
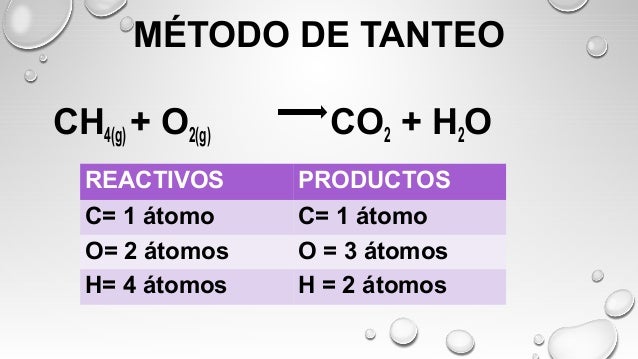
PROCEDIMIENTO
1. Se verifica si la ecuación química está balanceada; esto lo conseguimos contando la cantidad de átomos que tenemos de los elementos reactivos y comparándola con la cantidad que tenemos de producto.
2. Primero vamos a balancear los elementos Metálicos. (Buscamos los coeficientes que nos den la misma cantidad de reactivos que de productos en los elementos metálicos.
3. Balanceamos los elementos No metálicos.
4. Balanceamos los Hidrógenos.
5. Balanceamos los oxígenos.
6. Verificamos si efectivamente está balanceada.
* Balanceo REDOX
Es aquella en la cual una sustancia transfiere electrones a otra sustancia. La sustancia que pierde electrones se oxida, y la sustancia que gana electrones se reduce. A la sustancia que pierde electrones se le llama agente reductor; y la sustancia que gana electrones se le llama agente oxidante.
PROCEDIMIENTO
1. Asignar correctamente el número de oxidación (N.O.) a todos los átomos que participen en la reacción.
2. Identificar los átomos de los elementos que cambiaron su número de oxidación al pasar de reactivo a producto. Es decir determinar quién se oxidó y quién se redujo.
3. Escribir la semireacción de oxidación y la de reducción para cada elemento según se trate. Balancear cada semirreacción en cuanto al número de átomos del elemento e indicar el número total de átomos del elemento e indicar el número total de electrones ganados o perdidos.
4. Balancear la cantidad de electrones ganados o perdidos, de tal forma que sea la misma cantidad en ambas semireacciones. (Multiplica la semireacción de oxidación por el número de electrones ganados del elemento que se reduce. Y la semireacción de reducción por el número de electrones perdidos del elemento que se oxida).
5. Sumar las dos semireacciones para obtener una sola.
6. Los coeficientes encontrados se colocan en las fórmulas que corresponde a la ecuación original.
7. Por último, se termina de balancear la ecuación por tanteo.
8. Simplificar los coeficientes si se puede.
EJERCICIOS BALANCEO DE ECUACIONES
EJERCICIOS BALANCEO DE ECUACIONES
NIVEL 1
1.
SOLUCIÓN
2.
SOLUCIÓN
3.
SOLUCIÓN
4.
SOLUCIÓN
5.
SOLUCIÓN
NIVEL 2
1.
SOLUCIÓN
2.
SOLUCIÓN
3.
SOLUCIÓN
4.
SOLUCIÓN
5.
SOLUCIÓN
NIVEL 3
1.
SOLUCIÓN
2.
SOLUCIÓN
3.
SOLUCIÓN
4.
SOLUCION
5.
SOLUCIÓN
CONCLUSIÓN
Esta investigación seremos capaces de balancear correctamente cualquier ecuación química, así como también podremos reconocer si una ecuación química se encuentra correctamente balanceada y tendremos la capacidad de poder transmitir nuestros nuevos conocimientos a otros estudiantes.
También sabemos que una ecuación es la representación simbólica de las reacciones y que si los átomos no son de la misma cantidad tanto de reactivos como de productos la ecuación esta desequilibrada.
WEBGRAFIA
* https://es.slideshare.net/aeroscristh/balanceo-de-ecuaciones-qumicas-30434345
EJERCICIOS
* file:///C:/Users/Usuario/Downloads/balancing-chemical-equations_es.html






















































FALTÓ MAS MARCO TEORICO 4,0
ResponderEliminar